SimuLab 3:Investigación Cualitativa de la ley de Boyle |
Objetivo
:
Reconocer el efecto de las colisiones moleculares contra un pistón. Al realizar este simulab, usted será capaz de: Predecir qué le sucede a la posición del pistón cuando la presión externa es mayor que la presión interna del gas. Explicar porqué la posición del pistón fluctúa cuando las presiones internas y externas son aproximadamente iguales. Describir a la presión del gas en términos de colisiones moleculares. Enunciar la relación entre frecuencia de colisión y el volumen de una muestra dada de gas. |
Cuando
se tiene gas dentro de un recipiente (contenedor), el gas crea presión
porque sus partículas colisionan contra las paredes del contenedor.
El concepto de partículas en movimiento es el fundamento de la
teoría cinética molecular. La ley de Boyle establece que
en un gas ideal, a temperatura constante, y con un número de partículas
constantes, el producto: P.V = constante (P = presión, V = volumen). |
Comenzaremos
observando una película, la cual le dará una visión preliminar
de la ley de Boyle desde un punto de vista microscópico. Para poder ver la película siga las siguientes instrucciones: |
1.
Abra SMDPlayer, seleccione IntroBoyle'sLaw en el
directorio IdealGas. Presione Play. Lea todas las leyendas
y sigua las instrucciones. Al leer "The End" seleccione File
- Quit. |
| 2. Abra SMD, seleccione Boyle-Preliminary de la carpeta IdealGas. |
Usted
está visualizando 200 moléculas verdes de gas bajo un pistón
representado por una barra roja, como se muestra en la Figura
2.1. Note que está encendido el Baño
térmico, lo que significa que la temperatura del sistema se mantiene
constante a lo largo del experimento. El sistema NO se
encuentra térmicamente aislado. |
3.
Cambie Iterations Between Displays a 10. Seleccione Display
Particles by, y luego Trayectories, de esta forma ha seleccionado
ver las trayectorias que realizan las partículas. |
Las
partículas empezarán a moverse a lo largo de líneas rectas
con distintas velocidades. Cuando colisionan entre ellas o con el pistón
sus trayectorias cambian. Presione Start. |
4.
Pause la simulación, seleccione Display Particles by Particle
Type. |
La
presión externa actuando sobre el pistón lo acelera hacia abajo,
reduciendo el volumen del gas. En ausencia de colisiones, el gráfico
del volumen en función del tiempo es una parábola suave porque
el pistón cae libremente. Sin embargo, cuando una molécula colisiona
contra el pistón, instantáneamente la velocidad del pistón
cambia y el gráfico se modifica en su totalidad, convirtiéndose
en un conjunto de segmentos parabólicos. El conjunto de estos segmentos
parabólicos representa numerosas colisiones, éstas colisiones
generan una presión interna que empuja al pistón hacia arriba. |
5.
Presione Start y observe el gráfico Volume
versus Time, durante 4 unidades de tiempo aproximadamente (hasta que
el gráfico llene toda la pantalla) y después presione Pause.
Para copiar el gráfico en la "Galería de Instantáneas''
vaya a Take Snapshot :Graph. Obtendrá una instantánea
similar a la fig. 2.2. |
Figura. 2.2. 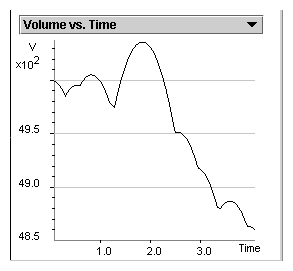 A través de un recuento de segmentos parabólicos se puede determinar el número de colisiones, de las partículas contra el pistón. El final de un segmento parabólico está indicado por un mínimo en la curva. En este gráfico hay 7 o 8 colisiones (segmentos parabólicos). |
P2.9:
¿Cuántas colisiones contra el pistón cuenta? (o sea de
segmentos parabólicos ) |
6.
Para aumentar la velocidad del programa, ponga Iterations Between Displays
en 1000 y presione Start. Corra el programa durante 200 unidades
de tiempo. |
En
el equilibrio, la presión interna creada por las moléculas de
gas colisionando contra el pistón tendría que ser igual a la
presión externa, la cual es 0.04. Seleccionando Show Additional
Parameters, usted verá el valor de la presión externa
y la presión interna se puede leer en el panel de Average Values.
Lea el volumen del gas del panel de Valores Promedio y tome nota. Mientras
corre la simulación responda las siguientes preguntas: |
P2.10: Note que un número relativamente pequeño de partículas colisionan con el pistón en algún momento en particular. Esto hace que la presión interna: (a) permanezca inalterada (b) fluctúe un poco (c) fluctúe mucho Explique su razonamiento. |
P2.11:
¿Si la presión externa es mayor que la presión interna,
que le pasará al pistón?
¿Si la presión externa es menor que la presión interna, que le pasará al pistón? |
P2.12: Si la presión interna es promediada a lo largo de un extenso período temporal de manera tal que el sistema llegue al equilibrio, la presión interna media será: (a) mayor (b) menor (c) igual a la presión externa ¿Puede explicar porqué? |
P2.13:
¿Qué le sucede al pistón en el equilibrio? |
P2.14:
¿Qué le sucede al volumen del gas en el equilibrio? ¿Sucede
esto en nuestras simulaciones? |
P2.15:
¿Cuál es el rol que juegan, en nuestras simulaciones, el
número de partículas en las fluctuaciones del volumen cuando
se ha alcanzado el equilibrio? |
P2.16:
Describa el estado de equilibrio de un gas dentro de un contenedor con
un pistón. |
|
7.
Presione Pause. Duplique la presión externa
(External Pressure) a 0.08. Para realizar esto posicione el mouse sobre la pestaña desplazable External Pressure, la que se halla ubicada dentro la opción Show Additional Parameters. |
P2.17:
Usando la ley de Boyle, pronostique ¿qué le pasará al
volumen promedio cuando se duplica la presión externa? |
Es
necesario actualizar los valores promedios luego de hacer modificaciones
como la que hizo al duplicar la presión. Estos datos de estadios
previos del experimento (cuando la presión era 0.04), se pueden anular
siguiendo el siguiente procedimiento. |
8.
Seleccione Reset Averages del panel de Valores Medios (Average
Values), y haga click. Presione Start. |
P2.18:
Describa que le sucede a la posición del pistón y explique el
porqué. ¿Puede observar cambios en el volumen del gas?
|
9.
Seleccione el gráfico de Presión en función del Tiempo.
Cuando el valor de la presión interna visualizada en el gráfico
se estabilice, es decir este muy cercana al de la presión externa,
presione Pause. Usted puede cuando la simulación está pausada, utilizar el mouse para saber cual es el valor tomado por la curva sobre el gráfico. Para realizar esto, ubique el mouse sobre la curva y haga click y mantenga presionado el botón del mouse. Observará dos valores, tiempo y presión. Anote el valor del volumen del gas que se observa en la Ventana de Promedios. |
Usted
está observando como el gas llega al equilibrio. Esto
sucede cuando la presiones externa y externa son aproximadamente iguales. |
P2.19:
Compare el volumen que anotó con sus predicciones. ¿Hasta
qué punto los resultados de la simulación son consistentes con
la ley de Boyle? |
10.
Ponga Iterations Between Displays de nuevo en 10. Seleccione el
gráfico Volume versus Time del panel gráfico.
Presione Start. Observa el gráfico durante aproximadamente
5 unidades de tiempo (hasta que el gráfico llene la pantalla), presione
entonces Pause y copie el gráfico en la "Galería
de Instantáneas'' seleccionando take Snapshot : Graph. |
Determine
el número de colisiones contra el pistón contando el número
de segmentos parabólicos, los cuáles representan el número
de colisiones contra el pistón. |
P2.20:
Compare los gráficos en términos del número de segmentos
parabólicos. ¿Puede dar una explicación de la proporción
de 1 a 2 observada? |
| P2.21: ¿Cómo está relacionado el cambio en el volumen con la frecuencia de colisiones contra el pistón?. |
P2.22:
¿Cómo se relaciona la frecuencia de colisiones con el cambio
en la presión externa? |
|
|