Capítulo 2Gases Ideales |
Dra.
Lidia A. Braunstein Depto. de Física FCEyN UNMdP, Argentina y Center For Polymer Studies, BU, USA Prof. Raúl H. Torres Depto. de Física FCEyN UNMdP, Argentina |
En muchas reacciones químicas se libera gas o estas ocurren totalmente en el estado gaseoso. La medición de los parámetros del gas, tales cómo el volumen y la temperatura, dan información acerca de la estequiometría de la reacción y de los cambios de energía que se producen en la reacción. Los parámetros del gas son: densidad, presión, volumen y temperatura. Estos parámetros a veces no cambian independientemente entre sí, ellos están relacionados entre sí a través de ciertas relaciones que se llaman leyes de los gases. La idea de que los gases están constituidos por un gran número de pequeñas partículas moviéndose al azar en todas las posibles direcciones da una explicación moderna para las leyes de los gases y es el fundamento de la Teoría Cinética Molecular.
El concepto de Presión
La materia existe en tres estados: sólido, líquido y gaseoso. Todos los sólidos preservan su forma y volumen. Los líquidos tales como el aceite, el agua y el alcohol son distintos de los sólidos. La diferencia con respecto a los sólidos es que los líquidos toman la forma de sus recipientes, pero preservan su volumen. Si tomas un litro de agua y la arrojas en una caja rectangular, seguirás teniendo el mismo volumen de agua, pero con forma cuadrada. Los gases, sin embargo, se comportan de manera distinta que los sólidos y los líquidos. Un gas no tiene forma ni volumen. Un gas se desparramará uniformemente y llenará el contenedor en el cuál se lo pone. Por ejemplo, si abrís una botella de perfume, el olor se desparramará en toda la habitación. Un ejemplo común de gas es el aire. A pesar de que no podemos verlo, está alrededor nuestro. Para probar que el aire existe basta con acercar la palma de tú mano a tú boca y soplar. Otra manera de ver al gas en acción es inflando un globo. Observe que el globo se llena y adquiere una forma a medida que crece. Después lo podes pinchar para experimentar la sensación del gas desparramándose a tú alrededor.
Práctica de laboratorio :
En la siguiente demostración verá como el aire se comporta como un "resorte".
-
una jeringa sin aguja.
-
un resorte
1. Ponga su pulgar sobre la lanzeta y con tú otra mano empuja el émbolo de la jeringa, como se muestra en la figura (a)
2. Empuje al pistón hacia la posición más baja posible y quite su mano de la manija rápidamente, soltando al pistón.(fig b)
|
|
||
fig. a |
fig. b |
¿Sentiste alguna resistencia a medida que empujabas el pistón?
Puedes explicar lo que ocurre.
Al retirar la mano ¿qué ocurre?
3. Ahora vamos a comprimir el resorte.
¿Sentiste alguna resistencia a medida que empujabas el resorte?
Puedes explicar lo que ocurre.
4 . Deja que se expanda el resorte.
Al retirar la mano ¿qué ocurre?
Una de las mayores contribuciones al estudio cuantitativo de tales
propiedades elásticas del aire la hizo el químico Irlandés
Robert Boyle (1627 - 1691) hacia la segunda mitad del siglo 17. El descubrió
que aunque lo que está actuando sobre el pistón es una
fuerza , el parámetro esencial es la cantidad de fuerza aplicada
por unidad de área. Boyle estaba hablando acerca del concepto
de presión. Boyle llevó a cabo experimentos cuantitativos
para medir la relación entre la presión y el volumen de
aire.
Presión es el cociente entre la fuerza y el área sobre
la cuál ésta fuerza es aplicada.
| Presión= | Fuerza
Área |
|
Solución:
Supongamos lo siguiente: La masa del libro es de 1 kg
Suponga que su mano es de =10cm×15cm, con lo cuál su área es de 150cm2. Ahora lo queremos convertir a m2 (m=metros). Recordando que un 1 m2=10.000cm2, haga lo siguiente:
Suponga que el área de tú dedo que está en contacto con el libro tiene 1 cm de largo y 3 mm ancho, con lo cuál su área es de 0.3cm2=0.3×10-4m2. Entonces, la presión es [ 10N/(3×10-5m2)] » 333000 Pascales.
Ley de Boyle
Robert Boyle determinó, a través de varios experimentos, que a temperatura constante el volumen de un gas es inversamente proporcional a su presión: V ~ [ 1/P], en otras palabras, el producto de P por V permanece constante cuando estas dos variables cambiaban: PV=const.
La ley de Boyle sugiere también que una de las propiedades de los gases es la tendencia a expandirse indefinidamente cuando la presión exterior se acerca a cero. En la época de Boyle ésta observación dio lugar a la idea falsa de que las partículas de gas se repelen entre sí.
Una centuria después de que Boyle dedujo su ley, el científico
francés Jacques Charles (1746 - 1823) descubrió la existencia
de una relación lineal entre la temperatura y el volumen del
gas a presión constante. Construyendo un gráfico de la
temperatura en función del volumen, descubrió que el volumen
de cualquier gas tendía a cero a -273C. No publicó estos
resultados. Veinte años después otro químico Francés,
Joseph Gay-Lussac, repitió el experimento de Charles, obtuvo
los mismos resultados, y los publicó. En ese momento, sin embargo,
en el laboratorio uno no podía llegar a temperatura cercanas
a -273C , Gay-Lussac sólo pudo demostrar su ley extrapolando
en sus gráficos con una línea el volumen hasta cortar
el eje de temperatura. Más adelante, a esta temperatura se la
llamó cero absoluto.
Joseph Gay-Lussac (1778-1850) continuó investigando a los gases
y realizó un experimento a volumen constante. El encontró
que, a volumen constante la presión aumenta linealmente con la
temperatura. El gráfico de la presión en función
de la temperatura es una línea recta. La pendiente de esta línea
depende del volumen y del número de partículas de la muestra
de gas. Al extrapolar ésta línea, para varios volúmenes,
encontró un cruce entre ellas aproximadamente en el punto P =
0, y T = -273C del gráfico. La temperatura de éste punto
coincide con la temperatura del gráfico de la ley Charles a presión
constante. A ésta temperatura el gas no ejerce ninguna presión.
Más adelante, a ésta temperatura se la llamó cero
absoluto, y fue entonces que se estableció la nueva escala de
temperaturas llamada Kelvin . Cero grados Kelvin, corresponden a -273C.
La presión del gas se debe a las colisiones de las partículas
contra las paredes, en consecuencia en el cero absoluto las partículas
del gas estarían quietas. En términos de la escala Kelvin
de temperatura, a la ley Gay-Lussac se la puede expresar como
P T |
= constante |
en donde la constante depende del volumen y del número de partículas
de la muestra de gas.
Gay-Lussac, fue uno de los primeros en usar globos aerostáticos
con propósitos científicos. Utilizando globos aerostáticos
de hidrógeno estudió el contenido químico de la
alta atmósfera. En 1804, Gay-Lussac superó la marca alcanzada
hasta entonces, llegando a una altitud de 7019 metros. A esta altitud
la presión atmosférica es 2.5 veces menor que la del nivel
del mar y la temperatura es de -20 C. A pesar de las duras condiciones,
Gay-Lussac realizó mediciones muy precisas de las propiedades
atmosféricas.
Principio
de Avogadro
A principios del siglo 19, la idea de que la materia estuviera constituida
por partículas individuales (o sea moléculas, átomos)
que pudieran estar o bien moviéndose o en estado estacionario
era muy controvertida. El químico Inglés John Dalton (1766-1844),
descubrió que en muchas reacciones químicas, las masas
de los reactivos y los productos formaban cocientes simples. Concluyó
de ésta observación que todos los compuestos químicos
están formados por átomos que se recombinan de otra manera
cuando ocurre una reacción química.
Esto era una verificación científica sobre la idea de
los átomos sugerida por Democritus en el año 400 A.C.
En 1809, Gay-Lussac realizó varios experimentos con gases reactivos
demostrando que a presión y temperatura constantes, el volumen
no necesariamente se conserva. En otras palabras, si se empieza una
reacción con tres volúmenes de un gas, no obtendrá
siempre tres volúmenes de gas después de la reacción;
la masa se conserva en una reacción química, el volumen
no necesariamente. Por ejemplo, si se mezclan dos volúmenes de
gas de hidrógeno con un volumen de oxígeno gaseoso a presión
constante, el producto de la reacción contendrá dos volúmenes
de agua.![]() 2
2
2H2( gas) +O2( gas) —› 2H2O(gas).
En este ejemplo, el número de átomos (o sea la masa)
se conserva, como se puede observar a cada lado de la ecuación.
El científico Italiano Avogadro (1776-1856) explicó los
resultados de los experimentos de Gay-Lussac, y concluyó enunciando
que en iguales volúmenes de cualquier gas a la misma temperatura
y presión hay el mismo número de partículas . El
nombre de esta unidad que representa un número fijo de partículas
es mol. Un mol contiene el número de Avogadro NA de moléculas,
NA=6.02 x 1023. Podemos, entonces, reformular la ley de " Gay-Lussac":
a temperatura y presión constantes el volumen de un gas es proporcional
al número n de moles
V n |
= constante |
Recordando que las colisiones moleculares con las paredes de un contenedor producen presión, entonces, para una reacción química realizada en un contenedor, a volumen constante, la ley de" Avogadro "dice: a temperatura y volumen constantes la presión es proporcional al número de moles del gas.
P n |
= constante |
Avogadro explicó los datos de Gay-Lussac usando el concepto de molécula. En nuestro Laboratorio Virtual investigaremos la dependencia de la presión con el número de partículas presentes en el cilindro.
Ley de los Gases Ideales
Hasta ahora, hemos estudiado cuatro leyes que describen el comportamiento
de los gases. Combinando la ley de Boyle, la de Charles, la de Gay-Lussac,
y el Principio de Avogadro, llegamos a la ecuación de estado
del gas:
PV NT |
= k |
en donde k es la constante de Boltzman y N es el número de partículas en el gas. Usualmente usamos moles en lugar de número de partículas, porque el número de partículas es enorme mientras que el número de moles en una muestra típica de gas en el laboratorio tiene valores más razonables. En un mol de gas hay número de Avogadro NA moléculas. Si el número de moles en la muestra de gas es n, entonces N=n NA es el número de partículas, entonces:
PV=nNAkT
Si definimos R=kNA podemos reescribir la ecuación del gas como:
PV=nRT, en donde R=8.31J/(K·mol) es la llamada constante universal
de los gases y n es el número de moles de gas. ésta última
ecuación que es la más conocida, es llamada ley de los
gases ideales. Las observaciones experimentales de Boyle, Charles y
Gay-Lussac sugieren que los gases poseen ciertas propiedades "ideales":
-
Los gases están compuestos de diminutas partículas. Se asume que estas partículas tiene volumen cero.
-
Las partículas del gas no interactúan entre sí, se mueven libremente en línea recta sin cambiar sus velocidades (a menos que colisionen contra las paredes del contenedor)
-
La presión del gas es producida por las colisiones de las partículas de gas contra las paredes del contenedor.
Sin embargo, un gas ideal no es real, sino más bien es una substancia
hipotética. Las moléculas de un gas real, en cambio, tienen
un pequeño volumen e interactúan entre sí. Por
lo tanto existen siempre desviaciones de la Ley de Gases Ideal. Cuando
las condiciones se asemejan a las "ideales" (i.e., a bajas
presiones y altas temperaturas) las desviaciones son muy pequeñas.
A veces las condiciones son "menos que ideales". En estas
condiciones, la propiedades de los gases ideales descritas arriba fallan.
Por ejemplo, a bajas temperaturas no podemos despreciar las interacciones
entre moléculas ya que éstas interacciones son las responsables
de las transiciones de fase. Discutiremos estos casos en actividades
posteriores.
Consecuencias de la ley de los Gases Ideales
-
Cuando se comprime un gas, a temperatura constante, las partículas del gas tienen menos espacio al derredor para moverse. Ellas colisionan contra las paredes con mayor frecuencia, entonces la presión interna aumenta conforme lo predice la ley de Boyle: PV=const.
- Cuando disminuimos la temperatura a volumen constante, la velocidad
de las partículas disminuye. Si el volumen es mantenido constante,
ellas colisionan con menor frecuencia, con lo cual ejercen menos fuerza
sobre las paredes del contenedor. Esto es consistente con la ley de
Gay-Lussac: [ P/T]=const. En el cero absoluto las partículas
tienen velocidad cero, por lo tanto no colisionan contra las paredes
y la presión interna es en consecuencia cero.
- Si la presión externa se mantiene constante y se baja la temperatura,
el volumen del gas disminuye. Al bajar la temperatura, las moléculas
se mueven más lento, por lo tanto colisionan con menor frecuencia.
Como consecuencia, la presión interna disminuye. Como la presión
externa es constante, el volumen del gas disminuye y entonces el número
de colisiones aumenta hasta lograr equilibrar la presión interna
con la externa. Estamos asumiendo que las partículas del gas
no tienen volumen y que la presión es generada solamente por
colisiones con las paredes del contenedor. Asumimos también que
el volumen del gas llegará a cero a la temperatura del cero absoluto.
Esto es consistente con la ley de Charles: [ V/T]=const.
- Cuando aumentamos el número de partículas manteniendo
constantes la temperatura y la presión externa, el número
de colisiones aumenta y el gas se expande. Esto es consistente con el
principio de Avogadro cuando la presión P y la temperatura T
son constantes: [ V/n]=const. Cuando V y T son constantes obtenemos
[ P/n]=const.
- Un mol de cualquier gas en condiciones normales de temperatura y presión (NTP), i.e. T=00=273K de temperatura y 1 atm de presión, ocupa [ RT/P]=[ 8.31 ×273/101,000] = 0.0224 m3=22.4 litros. La constante universal de los gases se mide, por lo común, en unidades de R=0.082 litros ×atm/Kelvin ×mol.
Para chequear la ley de los gases ideales en nuestro "Laboratorio
Virtual" obtendremos varias mediciones para diferentes valores
del volumen, temperatura, presión, número de partículas
y luego vamos a calcular el cociente [ PV/NT]. Si la ley de los gases
ideales es válida para nuestro sistema, este cociente debe permanecer
constante en un gran rango de los parámetros seleccionados y
no deberá depender de la masa de la partícula.
El valor numérico de [ PV/NT] nos dará el valor de la
constante de Boltzmann k en nuestras unidades de simulación.
En los sistemas reales, usando Joules y Kelvin como unidades k=1.38·10(-23)
J/K. En el "Laboratorio Virtual", la constante tendrá
un valor diferente ya que estamos usando unidades diferentes.
Basándonos en nuestra discusión acerca de la ley de los
gases ideales, sabemos que las partículas de un gas ideal no
colisionan entre sí(ya que los gases ideales no tienen volumen
no pueden entonces colisionar), mientras que en nuestro sistema colisionan.
Primero vamos a chequear la aplicabilidad de la ley de los gases ideales
a bajas densidades (i.e., cuando las colisiones son muy pocas). Por
otro lado, a bajas temperaturas el sistema condensa y se vuelve un líquido.
Usaremos, entonces, temperaturas lo suficientemente altas de manera
tal de reproducir el comportamiento de un gas ideal. Después
usaremos altas densidades y temperaturas más bajas para observar
las desviaciones con respecto al comportamiento ideal y estimar la región
de validez de la ley de gases ideales, i.e encontrar las condiciones
experimentales en las cuales [ PV/NT] es constante.
Cinética Molecular.
Daniel Bernoulli, el cual ya fue mencionado antes, propuso la idea
que las partículas se movían libremente en un volumen
sin interactuar unas con otras. Por lo tanto, se mueven a lo largo de
líneas rectas a velocidad constante. La presión del gas,
entonces, es causada por colisiones de las partículas de gas
con las paredes del contenedor, de la misma manera que una pelota de
tenis golpea sobre un frontón. Si disminuimos el volumen del
contenedor, las partículas del gas tiene menos espacio para moverse,
con lo cual colisionan con mayor frecuencia con las paredes, y en consecuencia
la presión interna aumenta hasta que iguala a la presión
externa. Bernoulli describió el comportamiento molecular y explicó
muchos fenómenos propios de los gases. Sigamos sus especulaciones
con la ayuda de nuestro Laboratorio Virtual Simulab "Bernoulli".
De aquí en adelante nos referiremos a las actividades y cuestiones
de este Simulab.
Empezamos con una partícula de gas en un contenedor cúbico
de largo L. (Véalo abriendo la pantalla del Simulab para el experimento
Bernoulli1 ). La velocidad de la partícula tiene tres componentes:
Vx, Vy y Vz. Estas componentes indican cuan rápido se mueve la
partícula en cada dirección. La velocidad total es (por
el teorema de Pitágoras) ![]() .
Consideremos por ahora sólo la dirección x. El período
de tiempo entre dos sucesivas colisiones es
.
Consideremos por ahora sólo la dirección x. El período
de tiempo entre dos sucesivas colisiones es ![]() =L/vx. En cada colisión, digamos con la pared
IZQUIERDA, la partícula cambia su velocidad de vinic=-vx
a vfin=vx.
Le lleva
=L/vx. En cada colisión, digamos con la pared
IZQUIERDA, la partícula cambia su velocidad de vinic=-vx
a vfin=vx.
Le lleva ![]() tiempos, porque la partícula sale de la pared izquierda y regresa
a esta. Esto significa que la aceleración media de la partícula,
ax, es
tiempos, porque la partícula sale de la pared izquierda y regresa
a esta. Esto significa que la aceleración media de la partícula,
ax, es
| ax= vx -(-vx) |
= | 2 vx |
= |
|
Por lo tanto, usando la ley de Newton F=ma, encontramos que la fuerza media ejercida por la pared sobre la partícula (y por la partícula sobre la pared) es Fx=mvx2/L. Si queremos calcular la fuerza ejercida por las N partículas cuando muchas de ellas tiene distintas velocidades, debemos usar los valores medios:
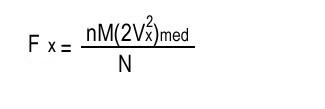
en donde
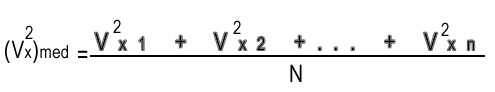
Entonces, la presión promedio es la fuerza media dividida por al área de la pared: P=F/A, por lo tanto
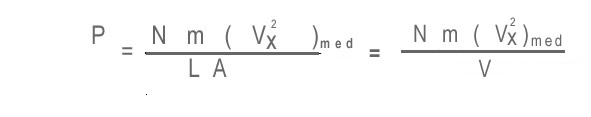
en donde V=LA es el volumen del cubo. Asumimos que todas las partículas
se mueven indistintamente en
las tres direcciones, ya que se mueven al azar.
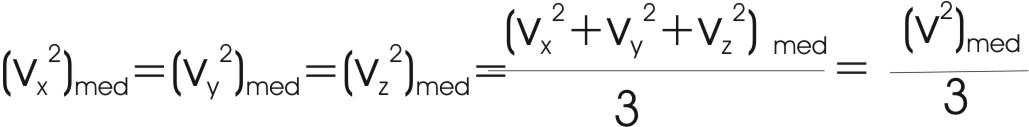
| Por lo tanto, | 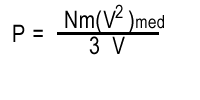 |
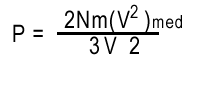 |
En el lado derecho de ésta última ecuación ha aparecido la familiar formula para la energía cinética media. Por lo tanto
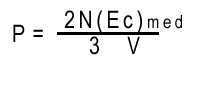
En nuestro SimuLabs el "mundo virtual" tiene sólo dos
dimensiones. Por lo tanto, en todas las cuentas en el Simulab , el factor
3 debe ser reemplazado por 2. La presión es igual a la densidad
de partículas veces dos tercios de la energía cinética
media de las partículas.
Más de 100 años después los científicos
relacionaron la energía cinética media de una molécula
con la temperatura absoluta del gas. Para un gas monoatómico
tridimensional. ![]() 3
3
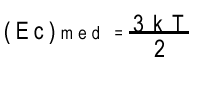 |
en donde k=1.38·10-23J/Kelvin
es la constante de Boltzmann. Sustituyendo la última ecuación
en la anterior se obtiene 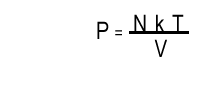 |
Usando el número de moles n=[ N/(NA)] en vez del número de moléculas e introduciendo la constante universal de los gases R=kNA=8.31 J/mole · Kelvin obtenemos PV=nRT, la cual es exactamente la ley de los gases ideales. La ley de los gases ideales fue originalmente derivada por Clapeyron y Mendeleiev como una generalización de las leyes experimentales de Boyle, Charles, Gay-Lussac y Avogadro. Vemos, entonces que está íntimamente relacionada con la cinética molecular diseñada por Bernoulli.
Ley de Dalton
Hasta ahora, las conjeturas del modelo de gas ideal predicen efectivamente el comportamiento del gas a bajas densidades y altas temperaturas. Trataremos de extender el modelo para poder predecir la presión producida por una mezcla de varias moléculas. Cómo definimos a las moléculas como objetos no interactuantes de volumen cero, cada una de ellas se moverá independientemente en el volumen. Ellas colisionarán con las paredes y producirán presión. Las moléculas de un tipo en particular producirán presión independientemente de la presencia (o ausencia) de otras moléculas. A esto se la llama presión parcial del gas. Las moléculas de otro tipo producirán su propia presión parcial. La presión total en el contenedor será la suma de todas estas presiones parciales. A este enunciado se lo conoce como la Ley Presiones Parciales de Dalton :
P=P1+P2
en donde P es la presión total, y P1 y P2 son las presiones parciales del Gas 1 y Gas 2 respectivamente. Note que cada presión parcial es Pi=RTni/V en donde ni es el número de moles del i-ésimo gas. En nuestro ejemplo i=1,2.
SimuLab:
Ley de Dalton
En nuestras simulaciones es más conveniente usar el número
de partículas en lugar del número de moles. Además,
en las unidades de simulación la constante de Boltzmann es k=1.
En consecuencia, las presiones parciales serán Pi=[(Ni)/V]T,
en donde N es el número de moléculas de cierto tipo
Referencias
(1) Esto no es verdad en los líquidos,
por ej. agua o mercurio; los líquidos no cambian significativamente
su volumen cuando están sometidos a presión. ![]()
(2) Por supuesto que tendremos
que esperar hasta que la temperatura del vapor de agua sea la misma
que antes de la reacción. ![]()
(3) En dos dimensiones tendríamos
(EC)med = [2/2]kT = kT. Nuestros SimuLabs, nuestros "laboratorios
virtuales " modelan gases bidimensionales . Además, en unidades
de simulaciones k=1, entonces, (EC)med = T. ![]()